P-TEFb

P-TEFb(positive transcription elongation factor b)は、真核生物においてRNAポリメラーゼII(Pol II)による転写の調節に必要不可欠な役割を果たすタンパク質複合体である[1]。ヒト遺伝子の大部分では、Pol IIは転写の開始直後にプロモーター近傍でトラップされる[2][3]。P-TEFbはサイクリン依存性キナーゼであり、DSIF(DRB sensitivity inducing factor)[4]とNELF(negative elongation factor)[5]、Pol II大サブユニットのC末端ドメイン(CTD)[6]をリン酸化し、これによってPol IIは生産的(productive)な伸長過程へ移行し、mRNAの合成が行われる。P-TEFbは7SK snRNPとの可逆的な結合によって部分的に調節される[7]。P-TEFbの阻害剤であるDRBやフラボピリドールで細胞を処理することで、mRNA産生の喪失、最終的には細胞死が引き起こされる[6][8]。
発見、構成と構造[編集]
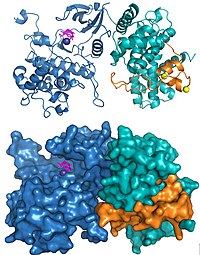
P-TEFbは、ショウジョウバエ細胞由来のin vitro転写系を用いた長いランオフ転写産物の形成に必要な因子として同定され、精製された[9]。P-TEFbは、ショウジョウバエでは触媒サブユニットであるCdk9と調節サブユニットであるサイクリンTからなるサイクリン依存性キナーゼである[10]。ヒトのP-TEFbには複数の種類が存在し、Cdk9といくつかのサイクリンサブユニット、サイクリンT1、T2、Kのうちの1つが含まれる[11][12]。P-TEFbはブロモドメインタンパク質BRD4を含む他の因子と結合し[13]、super elongation complexと呼ばれる巨大なタンパク質複合体に結合していることが知られている[14][15]。重要なことに、P-TEFbはHIVのTatタンパク質の標的であり[16]、Tatは正常な細胞内のP-TEFbの制御を迂回して、HIVゲノムのプロモーター近傍で停止したポリメラーゼに直接P-TEFbをもたらす[17][18]。
Cdk9とサイクリンT1を含むヒトP-TEFbの構造とHIV TatとP-TEFbの複合体構造がX線結晶構造解析によって解かれている。最初に解かれた構造では、2つのサブユニットが他のサイクリン依存性キナーゼで見られるような配置をしていることが示された[19]。元々の構造ではサブユニットに3つの意図しないアミノ酸置換が導入されていたが、その後正しい配列を用いて構造決定が行われ、活性部位周辺にいくつか大きな変化が見られた以外には、全体構造は同じであることが明らかにされた[20]。HIV TatがP-TEFbに結合した構造からは、ウイルスタンパク質はサイクリンT1サブユニットと広範囲にわたる接触面を形成していることが明らかにされた[20]。
P-TEFbの調節[編集]

P-TEFbは真核生物の遺伝子発現の制御に中心的な役割を果たすため、各サブユニットをコードする遺伝子の転写、mRNAの翻訳、タンパク質のターンオーバーのレベルで厳格に調節されており、さらに7SK snRNPが関与する珍しい機構によっても調節されている[7][21]。P-TEFbは二本鎖RNA結合タンパク質HEXIM(ヒトではHEXIM1またはHEXIM2)によって7SK snRNPに保持される。7SK RNAまたは他の二本鎖RNAに結合したHEXIMはP-TEFbに結合し、そのキナーゼ活性を阻害する[22][23]。7SK RNAには他の2つのタンパク質が常に結合している。MEPCE(methylphosphate capping enzyme)は7SK RNAの最初のヌクレオチドのγ-リン酸にメチル基を付加し[24]、LARP7(La-related protein 7)は7SK RNAの3'末端に結合する[25][26]。7SK snRNPからP-TEFbが抜き取られると、7SK RNAはコンフォメーション変化を起こし、HEXIMは放出されてhnRNPが除去された因子に置き換わる[7]。P-TEFbが再隔離されるためには、RNAの再編成、HEXIMの結合、そしてその後にP-TEFbの結合が起こる必要がある。
出典[編集]
- ^ Zhou, Qiang; Li, Tiandao; Price, David H. (2012). “RNA polymerase II elongation control”. Annual Review of Biochemistry 81: 119–143. doi:10.1146/annurev-biochem-052610-095910. ISSN 1545-4509. PMC 4273853. PMID 22404626.
- ^ Rahl, Peter B.; Lin, Charles Y.; Seila, Amy C.; Flynn, Ryan A.; McCuine, Scott; Burge, Christopher B.; Sharp, Phillip A.; Young, Richard A. (2010-04-30). “c-Myc regulates transcriptional pause release”. Cell 141 (3): 432–445. doi:10.1016/j.cell.2010.03.030. ISSN 1097-4172. PMC 2864022. PMID 20434984.
- ^ Cheng, Bo; Li, Tiandao; Rahl, Peter B.; Adamson, Todd E.; Loudas, Nicholas B.; Guo, Jiannan; Varzavand, Katayoun; Cooper, Jeffrey J. et al. (2012-01-13). “Functional association of Gdown1 with RNA polymerase II poised on human genes”. Molecular Cell 45 (1): 38–50. doi:10.1016/j.molcel.2011.10.022. ISSN 1097-4164. PMC 3259526. PMID 22244331.
- ^ Wada, T.; Takagi, T.; Yamaguchi, Y.; Ferdous, A.; Imai, T.; Hirose, S.; Sugimoto, S.; Yano, K. et al. (1998-02-01). “DSIF, a novel transcription elongation factor that regulates RNA polymerase II processivity, is composed of human Spt4 and Spt5 homologs”. Genes & Development 12 (3): 343–356. doi:10.1101/gad.12.3.343. ISSN 0890-9369. PMC 316480. PMID 9450929.
- ^ Yamaguchi, Y.; Takagi, T.; Wada, T.; Yano, K.; Furuya, A.; Sugimoto, S.; Hasegawa, J.; Handa, H. (1999-04-02). “NELF, a multisubunit complex containing RD, cooperates with DSIF to repress RNA polymerase II elongation”. Cell 97 (1): 41–51. doi:10.1016/s0092-8674(00)80713-8. ISSN 0092-8674. PMID 10199401.
- ^ a b Marshall, N. F.; Peng, J.; Xie, Z.; Price, D. H. (1996-10-25). “Control of RNA polymerase II elongation potential by a novel carboxyl-terminal domain kinase”. The Journal of Biological Chemistry 271 (43): 27176–27183. doi:10.1074/jbc.271.43.27176. ISSN 0021-9258. PMID 8900211.
- ^ a b c Peterlin, B. Matija; Brogie, John E.; Price, David H. (2012-01). “7SK snRNA: a noncoding RNA that plays a major role in regulating eukaryotic transcription”. Wiley interdisciplinary reviews. RNA 3 (1): 92–103. doi:10.1002/wrna.106. ISSN 1757-7012. PMC 3223291. PMID 21853533.
- ^ Chao, S. H.; Price, D. H. (2001-08-24). “Flavopiridol inactivates P-TEFb and blocks most RNA polymerase II transcription in vivo”. The Journal of Biological Chemistry 276 (34): 31793–31799. doi:10.1074/jbc.M102306200. ISSN 0021-9258. PMID 11431468.
- ^ Marshall, N. F.; Price, D. H. (1995-05-26). “Purification of P-TEFb, a transcription factor required for the transition into productive elongation”. The Journal of Biological Chemistry 270 (21): 12335–12338. doi:10.1074/jbc.270.21.12335. ISSN 0021-9258. PMID 7759473.
- ^ Peng, J.; Marshall, N. F.; Price, D. H. (1998-05-29). “Identification of a cyclin subunit required for the function of Drosophila P-TEFb”. The Journal of Biological Chemistry 273 (22): 13855–13860. doi:10.1074/jbc.273.22.13855. ISSN 0021-9258. PMID 9593731.
- ^ Fu, T. J.; Peng, J.; Lee, G.; Price, D. H.; Flores, O. (1999-12-03). “Cyclin K functions as a CDK9 regulatory subunit and participates in RNA polymerase II transcription”. The Journal of Biological Chemistry 274 (49): 34527–34530. doi:10.1074/jbc.274.49.34527. ISSN 0021-9258. PMID 10574912.
- ^ Peng, J.; Zhu, Y.; Milton, J. T.; Price, D. H. (1998-03-01). “Identification of multiple cyclin subunits of human P-TEFb”. Genes & Development 12 (5): 755–762. doi:10.1101/gad.12.5.755. ISSN 0890-9369. PMC 316581. PMID 9499409.
- ^ Yang, Zhiyuan; Yik, Jasper H. N.; Chen, Ruichuan; He, Nanhai; Jang, Moon Kyoo; Ozato, Keiko; Zhou, Qiang (2005-08-19). “Recruitment of P-TEFb for stimulation of transcriptional elongation by the bromodomain protein Brd4”. Molecular Cell 19 (4): 535–545. doi:10.1016/j.molcel.2005.06.029. ISSN 1097-2765. PMID 16109377.
- ^ Smith, Edwin; Lin, Chengqi; Shilatifard, Ali (2011-04-01). “The super elongation complex (SEC) and MLL in development and disease”. Genes & Development 25 (7): 661–672. doi:10.1101/gad.2015411. ISSN 1549-5477. PMC 3070929. PMID 21460034.
- ^ He, Nanhai; Liu, Min; Hsu, Joanne; Xue, Yuhua; Chou, Seemay; Burlingame, Alma; Krogan, Nevan J.; Alber, Tom et al. (2010-05-14). “HIV-1 Tat and host AFF4 recruit two transcription elongation factors into a bifunctional complex for coordinated activation of HIV-1 transcription”. Molecular Cell 38 (3): 428–438. doi:10.1016/j.molcel.2010.04.013. ISSN 1097-4164. PMC 3085314. PMID 20471948.
- ^ Kao, S. Y.; Calman, A. F.; Luciw, P. A.; Peterlin, B. M. (1987 Dec 3-9). “Anti-termination of transcription within the long terminal repeat of HIV-1 by tat gene product”. Nature 330 (6147): 489–493. doi:10.1038/330489a0. ISSN 0028-0836. PMID 2825027.
- ^ Zhu, Y.; Pe'ery, T.; Peng, J.; Ramanathan, Y.; Marshall, N.; Marshall, T.; Amendt, B.; Mathews, M. B. et al. (1997-10-15). “Transcription elongation factor P-TEFb is required for HIV-1 tat transactivation in vitro”. Genes & Development 11 (20): 2622–2632. doi:10.1101/gad.11.20.2622. ISSN 0890-9369. PMC 316609. PMID 9334325.
- ^ Garber, M. E.; Wei, P.; Jones, K. A. (1998). “HIV-1 Tat interacts with cyclin T1 to direct the P-TEFb CTD kinase complex to TAR RNA”. Cold Spring Harbor Symposia on Quantitative Biology 63: 371–380. doi:10.1101/sqb.1998.63.371. ISSN 0091-7451. PMID 10384302.
- ^ Baumli, Sonja; Lolli, Graziano; Lowe, Edward D.; Troiani, Sonia; Rusconi, Luisa; Bullock, Alex N.; Debreczeni, Judit E.; Knapp, Stefan et al. (2008-07-09). “The structure of P-TEFb (CDK9/cyclin T1), its complex with flavopiridol and regulation by phosphorylation”. The EMBO journal 27 (13): 1907–1918. doi:10.1038/emboj.2008.121. ISSN 1460-2075. PMC 2486423. PMID 18566585.
- ^ a b Tahirov, Tahir H.; Babayeva, Nigar D.; Varzavand, Katayoun; Cooper, Jeffrey J.; Sedore, Stanley C.; Price, David H. (2010-06-10). “Crystal structure of HIV-1 Tat complexed with human P-TEFb”. Nature 465 (7299): 747–751. doi:10.1038/nature09131. ISSN 1476-4687. PMC 2885016. PMID 20535204.
- ^ Quaresma, AJ; Bugai A; Barboric M. (2016). “Cracking the control of RNA polymerase II elongation by 7SK snRNP and P-TEFb.”. Nucleic Acids Research 44 (8): 7527–7539. doi:10.1093/nar/gkw585. PMC 5027500. PMID 27369380.
- ^ Li, Qintong; Cooper, Jeffrey J.; Altwerger, Gary H.; Feldkamp, Michael D.; Shea, Madeline A.; Price, David H. (2007). “HEXIM1 is a promiscuous double-stranded RNA-binding protein and interacts with RNAs in addition to 7SK in cultured cells”. Nucleic Acids Research 35 (8): 2503–2512. doi:10.1093/nar/gkm150. ISSN 1362-4962. PMC 1885667. PMID 17395637.
- ^ Michels, Annemieke A.; Fraldi, Alessandro; Li, Qintong; Adamson, Todd E.; Bonnet, François; Nguyen, Van Trung; Sedore, Stanley C.; Price, Jason P. et al. (2004-07-07). “Binding of the 7SK snRNA turns the HEXIM1 protein into a P-TEFb (CDK9/cyclin T) inhibitor”. The EMBO journal 23 (13): 2608–2619. doi:10.1038/sj.emboj.7600275. ISSN 0261-4189. PMC 449783. PMID 15201869.
- ^ Jeronimo, Célia; Forget, Diane; Bouchard, Annie; Li, Qintong; Chua, Gordon; Poitras, Christian; Thérien, Cynthia; Bergeron, Dominique et al. (2007-07-20). “Systematic analysis of the protein interaction network for the human transcription machinery reveals the identity of the 7SK capping enzyme”. Molecular Cell 27 (2): 262–274. doi:10.1016/j.molcel.2007.06.027. ISSN 1097-2765. PMC 4498903. PMID 17643375.
- ^ Krueger, Brian J.; Jeronimo, Célia; Roy, Bibhuti Bhusan; Bouchard, Annie; Barrandon, Charlotte; Byers, Sarah A.; Searcey, Courtney E.; Cooper, Jeffrey J. et al. (2008-04). “LARP7 is a stable component of the 7SK snRNP while P-TEFb, HEXIM1 and hnRNP A1 are reversibly associated”. Nucleic Acids Research 36 (7): 2219–2229. doi:10.1093/nar/gkn061. ISSN 1362-4962. PMC 2367717. PMID 18281698.
- ^ He, Nanhai; Jahchan, Nadine S.; Hong, Eunmee; Li, Qiang; Bayfield, Mark A.; Maraia, Richard J.; Luo, Kunxin; Zhou, Qiang (2008-03-14). “A La-related protein modulates 7SK snRNP integrity to suppress P-TEFb-dependent transcriptional elongation and tumorigenesis”. Molecular Cell 29 (5): 588–599. doi:10.1016/j.molcel.2008.01.003. ISSN 1097-4164. PMC 6239424. PMID 18249148.
